我院干细胞与动物疾病团队培育获得抗病高产双基因(CD163-MSTN)编辑改良猪
2022年10月9日,我院干细胞与动物疾病团队和云南农业大学魏红江团队合作在 Zoological Research 杂志在线发表题为“Optimization of sgRNA-expression strategy to generate multiplex gene-editing pigs”的论文,探索出高效培育多基因编辑猪的sgRNA表达方案。这一进展是西北地区首次成功获得多基因编辑克隆猪,标志着西北地区生猪产业基因编辑生物育种技术达到世界先进水平。
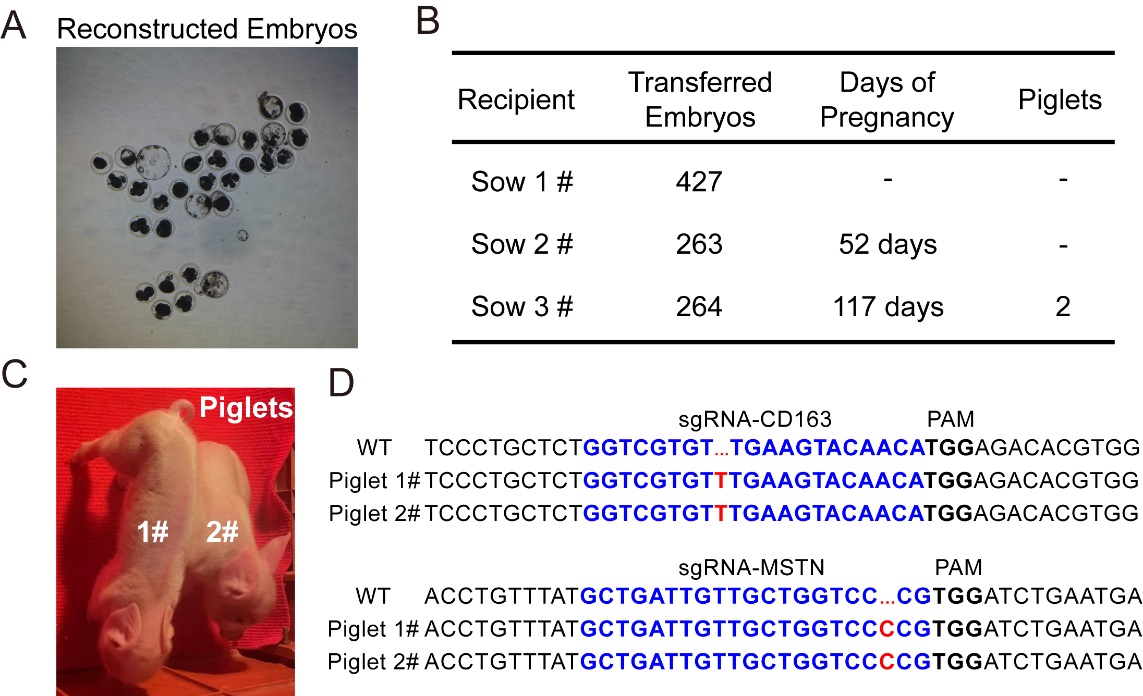
图1纯合子多基因编辑猪的出生与鉴定
以猪肺泡巨噬细胞(porcine alveolar macrophages, PAM)为主要受体细胞的猪繁殖和呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)在过去几十年中对全球养猪业造成了重大的经济损失。鉴于CD163是PRRSV是PAM的主要受体,对猪CD163的敲除可以获得对PRRSV感染具有强抵抗能力的猪品种。此外,通过基因编辑敲除猪肌肉抑制因子MSTN(myostatin)所获得的后代表现出显著提高的肌肉比例。对猪多个基因的同时编辑并最终培育出具有优良特性的新品种在在未来畜牧生产领域展示出巨大的应用前景。
基于前期的研究,CRISPR/Cas9技术主要有三种策略用于动物和植物多基因编辑,包括共转染携带不同sgRNA的质粒,用转染单个含有串联sgRNA表达盒的质粒,以及转染含有多顺反子sgRNA的载体(PTG策略)。该团队构建了携带三种靶向MSTN和CD163的sgRNA表达装置的载体系统,并量化了它们在猪胎儿成纤维细胞中的编辑效率。结果表明,串联sgRNA表达盒的策略可以有效地实现猪的多基因改良。将CD163和MSTN同时编辑的猪胎儿成纤维细胞进行体细胞核移植试验,利用三头**母猪最终产下两头双基因编辑仔猪。全基因组测序结果证实两头基因编辑猪均未出现预期之外的基因组改变。
鉴于传统显微注射培育基因编辑猪策略往往产生杂合子或者嵌合体动物,而后续纯合子的选育过程需要消耗大量的时间和经济成本,本研究所报道的技术方案显然是经济而高效的,其所培育的CD163和MSTN双基因编辑猪也为后续培育抗猪繁殖与呼吸障碍综合征种猪及高瘦肉率种猪提供了优秀种质材料。
本文的通讯作者为西北农林科技大学的华进联教授和云南农业大学的魏红江教授。第一作者为西北农林科技大学的2019级博士生张炬庆,云南农业大学的郭建雄、西北农林科技大学动物医学院硕士生吴筱洁和西北农林科技大学动物科技学院王禹教授为文章的共同第一作者。
本研究受到国家自然科学基金、陕西省重点科技创新团队项目和陕西省重点产业链项目等资助。
论文原文链接为:Optimization of sgRNA expression strategy to generate multiplex gene-edited pigs (zoores.ac.cn)